Figura 1. La vía canónica y no canónica de señalización NF-kB
¿Qué es NF-kB?
NF-kB es un nombre corto de factor nuclear kappa-light-chain-enhancer de células B activadas. No es una sola proteína, sino una pequeña familia de factores de transcripción inducibles que juegan un papel importante en casi todas las células de mamíferos. Controla la transcripción del ADN, la producción de citoquinas, la supervivencia celular y otros eventos celulares importantes, especialmente desempeñan un papel clave en la regulación de la respuesta inmune a la infección.
NF-kB molecular son generalmente dímeros., Una estructura típica de NF-kB es el dímero P50-P65 (NF-kB1/RelA). La formación de dímeros es necesaria para la Unión del ADN, dos monómeros NF-kB se unen al ADN como un dímero. Las regiones N-terminales del dímero son responsables del contacto específico del ADN. Las regiones C-terminales suelen ser altamente conservadas, son responsables de la dimerización y el contacto inespecífico de fosfato de ADN. Todo el NF-kB molecular es como un tornillo de apriete en la cadena de ADN y funciona como un factor de transcripción (figura 2).
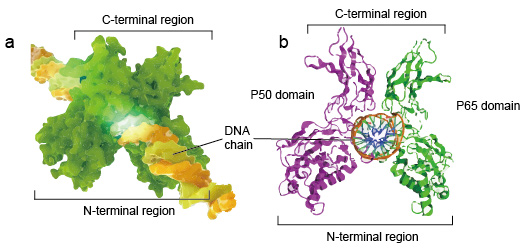
la Figura 2. Estructura de la Unión del dímero de proteína NF-kB con la cadena de ADN.,
familia NF-kB
porque los miembros de la familia NF-kB comparten homología estructural con la oncoproteína retroviral v-Rel. así que también llamaron proteínas NF-kB / Rel. La familia de factores de transcripción NF-kB en mamíferos consiste en 5 proteínas: P65 / RelA, RelB, c-Rel, p105 / p50 (NF-kB1), y p100/p52 (NF-kB2). Estas 5 proteínas se asocian entre sí y forman distintos complejos homo/heterodiméricos transcripcionalmente activos (Figura 3). Todos ellos comparten un dominio de homología rel (RHD) conservado común de 300 aa de longitud., Estos dominios RHD tienen múltiples funciones como dimerización, unión de ADN, interacción con IkBs y translocación nuclear. Aunque los miembros de la familia de proteínas NF-kB pueden formar hasta 15 dímeros diferentes, pero muchos de ellos aún no han demostrado. La forma más abundante de dímero NF-kB es el heterodímero p50 / p65 que ha sido fundida en casi todos los tipos celulares. Como solo P65 / Rel, RelB y c-Rel tienen dominios de transactivación carboxi-terminal (TAD), la familia de proteínas NF-kB se puede dividir en dos grupos., p50 Y p52 son generados por el procesamiento de las moléculas precursoras p105 y P100, respectivamente. Por lo tanto, no todas las combinaciones de dímeros Rel son transcripcionalmente activas.
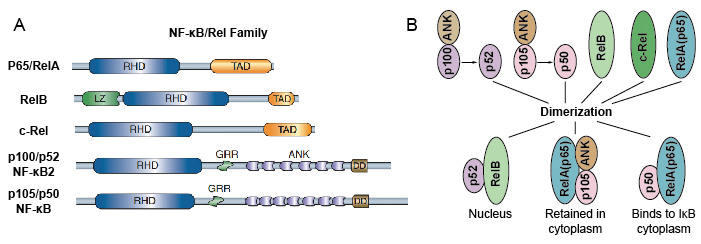
la Figura 3. The 5 protein and their homo / heterodimeric complexes of NF-kB family.
NF-kB signaling pathway
NF-kB protein dimmers as nuclear transcription factor, they need to migrate to the nucleus, combined with DNA to have function. En la mayoría de los tipos de células normales en estado de reposo, el NF-KB estaba inactivo y retenido en el citoplasma., Se unen a un inhibidor específico llamado proteína IK-B, que podría unirse al dominio de homología Rel (RHD) de NF-kB e interferir con su función de secuencia de localización nuclear (NLS). Estas proteínas inhibidoras, que incluyen IkBa, IkBb e IkBg, contienen 6-7 repeticiones de anquirina que median la unión a la RHD. Estas repeticiones también están presentes en las mitades C-terminales de los precursores NF-kB2/p100 y NF-kB1/p105, que también funcionan como IkBs y retienen a sus parejas, las proteínas Rel, en el citoplasma., Para activar el NF-kB molecular, las células primero necesitan separar la proteína NF-kB de sus inhibidores. Hay dos vías principales de señalización que conducen a la disociación del inhibidor de la proteína IK-B del atenuador NF-kB y permiten la translocación de los dímeros NF-kB del citoplasma al núcleo.
1., Cascada canónica / clásica
señalización canónica o clásica en cascada a partir del receptor de la superficie celular de citocinas proinflamatorias y patrones moleculares asociados con patógenos (PAMPs), como el receptor del factor de necrosis tumoral (TNFR), el receptor tipo toll (TLR) y el receptor de células T/B. Estos receptores que se unen con sus moléculas de ligando y transfieren la señal a través de la membrana celular, causan la activación del complejo IKB quinasa (IKK). La forma más común de este complejo consiste en heterodímeros de subunidades catalíticas IKKa e IKKß y una subunidad reguladora IKKy., La unidad IKKy también se llama NEMO para NF-kB essential modulator. El complejo IKK activado, que actúa predominantemente a través de IKKß de una manera dependiente de IKKy, cataliza la fosforilación de IkBs (en sitios equivalentes a Ser32 y Ser36 de IkBa), la poliubiquitinación (en sitios equivalentes a Lys21 y Lys22 de IkBa) y la posterior degradación por el proteasoma 26S. Los dímeros NF-kB liberados (más comúnmente el dímero P50–RelA), se translocan al núcleo, se unen al ADN y activan la transcripción del gen descendente.
2., Cascada de vías no canónicas/alternativas
otra vía activadora de NF-kB llamada Vía no canónica o alternativa. Esta vía es independiente de IKKß e IKKy, pero depende de IKKa dimmer en su lugar. La transferencia de señalización al citoplasma a través del receptor LT-β o BAFF. Fosfonato de un NIK proteína, NIK proteína, a continuación, fosfonato de la IKKa homodimmers. El objetivo para los homodímeros IKKa en esta vía es NF-kB2 / p100, que es fosforilado en dos sitios C-terminales., La fosforilación de estos sitios es esencial para el procesamiento de p100 a p52, que también depende de la poliubiquitinación y la degradación proteasómica. Sin embargo, en lugar de llevar a la degradación completa de p100, como se ve con IkBs, la ubiquitinación dependiente de la fosforilación de p100 resulta solo en la degradación de sus partes C-terminales inhibitorias. Una vez que la mitad C-terminal se degrada, la porción N-terminal de NF-kB (el polipéptido p52 que contiene la RHD) se libera., Como el RHD de p100 se asocia más comúnmente con RelB, la activación de esta vía ‘alternativa’ resulta en la translocación nuclear de los dímeros P52–RelB. El dímero finalmente se une al ADN y activa la transcripción del gen descendente.
3. La ubiquitina es una proteína de 76 aminoácidos que está altamente conservada y se expresa de forma ubicua en todos los eucariotas, desde la levadura hasta el ser humano. El ácido carboxílico en la glicina C-terminal de ubiquitina se puede unir covalentemente a la amina epsilon de lisina en otra proteína a través de un enlace isopéptido. Este proceso se llama «ubiquitinación»., Además, la cola C-terminal de la ubiquitina se puede unir directamente a la metionina N-terminal de otra ubiquitina para formar una cadena de poliubiquitina lineal. La ubiquitinación desempeña un papel esencial en la regulación de las vías de NF-kB. En las células no estimuladas, NF-kB se une a las proteínas inhibitorias de la familia kB (IkB) y se secuestra en el citoplasma., Tras la estimulación, el IkB es fosforilado por el complejo IkB quinasa (IKK), el IKB fosforilado es posteriormente ubiquitinado y degradado por el proteasoma 26S, lo que permite que el NF-kB se trasloce al núcleo, donde regula la expresión de una gran cantidad de genes. Como subunidad reguladora del complejo IKK, se ha propuesto que NEMO sea el factor clave para la transducción de la señal de ubiquitinación a la activación IKK. Varios DUBs funcionan como reguladores negativos clave de IKK para permitir un control estricto de la activación de NF-kB., Uno de los DUBs mejor estudiados es A20, se ha propuesto que A20 suprima la hiperactivación de NFkB desubiquitinando la poliubiquitina ligada a K63 unida a RIP1 a través del dominio OTU N-terminal, así como promoviendo la poliubiquitinación ligada a K48 de RIP1 para la degradación proteasómica.
4. NF-kB actúa como un mediador central de las respuestas inmunitarias e inflamatorias, y está involucrado en las respuestas al estrés y la regulación de la proliferación celular y la apoptosis. Los respectivos genes diana NF-kB permiten al organismo responder eficazmente a estos cambios ambientales., La vía clásica de NF-kB es activada por una variedad de señales inflamatorias, lo que resulta en la expresión de coordenadas de múltiples genes inflamatorios e inmunes innatos. Las citocinas proinflamatorias IL-1B y TNF-a activan NF-kB, y su expresión es inducida en respuesta a la activación de NF-kB, formando así un bucle de alimentación hacia adelante amplificante. La ruta alternativa para NF-kB resulta en la translocación nuclear de los dímeros P52-RelB, depende estrictamente de los homodímeros IKKa y es activada por LTbR, BAFF y CD40L por NIK., Muchos datos sugieren fuertemente que la vía alternativa juega un papel central en la expresión de los genes involucrados en el desarrollo y mantenimiento de los órganos linfoides secundarios. Los factores de transcripción de la familia NF-kB controlan la expresión de un gran número de genes diana en respuesta a los cambios en el medio ambiente, ayudando así a orquestar las respuestas inflamatorias e inmunitarias.
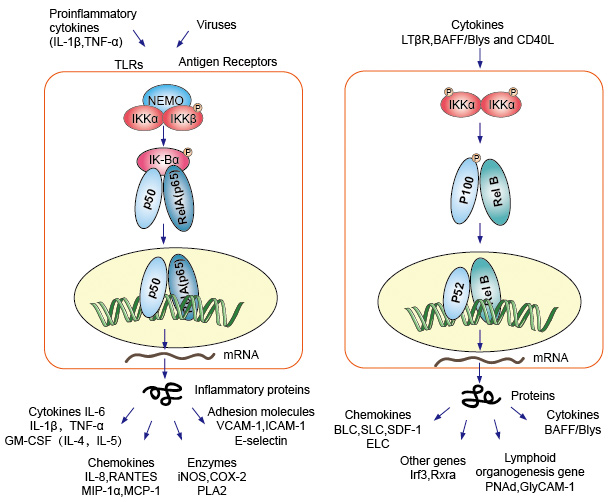
la Figura 4. Down-stream signaling of NF-kB signaling pathway.
5. Relación con las enfermedades.
- La base inflamatoria de las enfermedades metabólicas.,
LA VÍA DE SEÑALIZACIÓN IKK/NF-kB es clave para vincular el metabolismo, la inflamación y la acción de la insulina. La mayoría de las señales de estrés metabólico que resultan en resistencia a la insulina o disfunción de las células β pancreáticas, ya sea inducida por señales intracelulares o extracelulares, convergen en la cinasa activadora de NF-kB IKKb y otra quinasa inflamatoria principal, la proteína quinasa activada por mitógeno JNK (MAPK).
- NF-kB y glucólisis.
la glicólisis puede generar ATP en mayores cantidades y a una velocidad más rápida que la fosforilación oxidativa., Por lo tanto, la glucosa es un nutriente esencial para el cáncer y las células proliferantes normales. NF-kB coordina muchas de las señales que impulsan la activación y proliferación celular durante la inmunidad, la inflamación y la oncogénesis.
- NF-kB y metabolismo oxidativo.
NF-kB gobierna la homeostasis de la energía y la adaptación metabólica mediante el control del equilibrio entre la glucólisis y la respiración para el suministro de energía. La inhibición de NF-kB/RelA por diversos medios disminuyó el consumo de oxígeno y causó la reprogramación a glucólisis aeróbica