Rysunek 1. Ścieżka sygnalizacji kanonicznej i niekanonicznej NF-kB
czym jest NF-kB?
NF-kB to skrócona nazwa czynnika jądrowego kappa-light-chain-enhancer aktywowanych komórek B. Nie jest to pojedyncze białko, ale mała rodzina indukowanych czynników transkrypcyjnych, które odgrywają ważną rolę w prawie wszystkich komórkach ssaków. Kontroluje transkrypcję DNA, produkcję cytokin, przeżywalność komórek i inne ważne wydarzenia komórkowe, szczególnie odgrywają kluczową rolę w regulacji odpowiedzi immunologicznej na infekcję.
NF-kB są zwykle dimerami., Typową strukturą NF-kB jest dimer P50-P65 (NF-kB1 / RelA). Tworzenie dimerów jest niezbędne do wiązania DNA, dwa monomery NF-kB wiążą się z DNA jako dimer. N-końcowe regiony dimeru są odpowiedzialne za specyficzny kontakt DNA. C-końcowe regiony są zwykle silnie konserwowane, są odpowiedzialne za dimeryzację i niespecyficzny kontakt fosforanu DNA. Cała cząsteczka NF-kB jest jak imadło szczypcowe na łańcuchu DNA i funkcjonuje jako czynnik transkrypcyjny (ryc. 2).
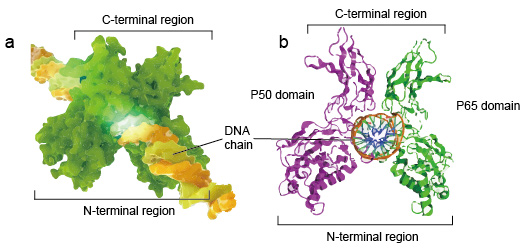
Rysunek 2. Struktura dimeru białka NF-kB wiążącego się z łańcuchem DNA.,
rodzina NF-kB
ponieważ członkowie rodziny NF-kB dzielą homologię strukturalną z retrowirusową onkoproteiną v-Rel. tak też nazywali białka NF-kB/rel. Rodzina czynników transkrypcyjnych NF-kB u ssaków składa się z 5 białek: p65/RelA, RelB, C-Rel, p105/p50 (NF-kB1) i p100/P52 (NF-KB2). Te 5 białek kojarzy się ze sobą i tworzą odrębne transkrypcyjnie aktywne kompleksy homo / heterodimeryczne(ryc. 3). Wszystkie mają wspólną, zachowywaną domenę homologii rel (RHD) o długości 300 aa., Te domeny RHD mają wiele funkcji, takich jak dimeryzacja, Wiązanie DNA, interakcja z IkBs i translokacja jądrowa. Chociaż członkowie rodziny białek NF-kB mogą tworzyć do 15 różnych dimerów, ale wiele z nich jeszcze nie wykazało. Najobficiej występującą formą dimeru NF-kB jest heterodimer p50/p65, który występuje niemal we wszystkich typach komórek. Ponieważ tylko P65 / rel, RelB i C-rel mają domeny karboksy-terminalnej transactivation (TAD), rodzina białek NF-kB może być dalej podzielona na dwie grupy., p50 i p52 są generowane przez przetwarzanie cząsteczek prekursorowych p105 i P100, odpowiednio. W związku z tym nie wszystkie kombinacje dimerów Rel są transkrypcyjnie aktywne.
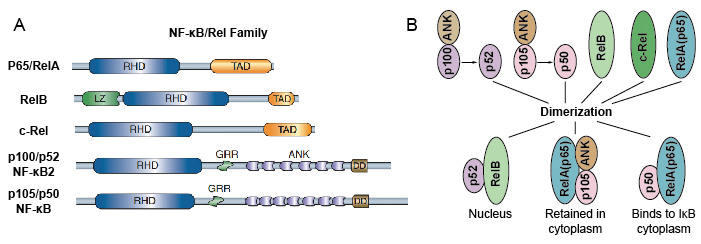
Rysunek 3. Białka 5 i ich kompleksy homo / heterodimeryczne z rodziny NF-kB.
szlak sygnałowy NF-kB
ściemniacze białek NF-kB jako czynnik transkrypcji jądrowej, muszą migrować do jądra, w połączeniu z DNA, aby mieć funkcję. U większości typów komórek normalnych w stanie spoczynku NF-KB był nieaktywny i zatrzymywał się w cytoplazmie., Wiążą się one ze specyficznym inhibitorem zwanym białkiem IK-B, który może wiązać się z domeną homologiczną rel (RHD) NF-kB i zakłócać jego sekwencję lokalizacji jądrowej (NLS). Te białka inhibitorów, które obejmują IkBa, IkBb i IkBg, zawierają 6-7 powtórzeń ankyrin, które pośredniczą w wiązaniu z RHD. Powtórzenia te są również obecne w połówkach końcowych prekursorów NF-kB2/p100 i NF-kB1/p105, które również działają jako IKB i zachowują swoich partnerów, białka Rel, w cytoplazmie., Aby aktywować cząsteczkę NF-kB, komórki najpierw muszą oddzielić białko NF-kB od inhibitorów. Istnieją dwa główne szlaki sygnałowe prowadzące do dysocjacji inhibitora białka IK-B ze ściemniacza NF-kB i translokacji dimerów NF-kB z cytoplazmy do jądra.
1., Kaskada kanoniczna/klasyczna
kanoniczna lub klasyczna sygnalizacja kaskadowa rozpoczynająca się od receptora powierzchniowego komórek cytokin prozapalnych i wzorców molekularnych związanych z patogenem (PAMPs), takich jak receptor czynnika martwicy nowotworów (TNFR), receptor toll-podobny (TLR) i receptor komórek T/B. Receptory te wiążące się z cząsteczkami ligandu i przenoszą sygnał przez błonę komórkową, powodują aktywację kompleksu kinazy IkB (IKK). Najczęstszą formą tego kompleksu są heterodimery z podjednostek katalitycznych IKKa i IKKß oraz podjednostka regulacyjna IKKy., Jednostka IKKy zwana również NEMO dla modulatora NF-kB essential. Aktywowany kompleks IKK, działający głównie poprzez IKKß w sposób zależny od IKKy, katalizuje fosforylację IkBs( w miejscach odpowiadających Ser32 i Ser36 IkBa), poliubikwitynację (w miejscach odpowiadających Lys21 i Lys22 IkBa), a następnie degradację przez proteasom 26S. Uwalniane dimery NF-kB (najczęściej dimer P50–RelA), translokują się do jądra, wiążą DNA i aktywują transkrypcję genu w dół strumienia.
2., Non-canonical/Alternative pathway Cascade
inna ścieżka aktywująca NF-kB o nazwie no-canonical lub alternative pathway. Ta ścieżka jest niezależna od IKKß i IKKy, ale zależy od ściemniacza IKKa. Transfer sygnałowy do cytoplazmy przez receptor LT-β lub Baffa. Fosfonat białka NIK, białko NIK następnie fosfonat Homodimmerów IKKa. Celem homodimerów IKKa w tym szlaku jest NF-kB2/p100, który jest fosforylowany w dwóch miejscach Terminalu C., Fosforylacja tych miejsc jest niezbędna do przetwarzania p100 do p52, który jest również zależny od poliubikwitynacji i degradacji proteasomalnej. Jednak zamiast prowadzić do całkowitej degradacji p100, jak to widać w przypadku IkBs, zależna od fosforylacji ubikwitynacja p100 powoduje tylko degradację hamujących części końcowych C. Po zdegradowaniu części końcowej C, uwalniana jest N-końcowa część NF-kB (polipeptyd p52 zawierający RHD)., Ponieważ RHD p100 jest najczęściej związany z Relbem, aktywacja tego „alternatywnego” szlaku powoduje jądrową translokację dimerów P52-RelB. Dimer ostatecznie wiąże się z DNA i aktywuje transkrypcję genu w dół strumienia.
3. Regulacja ścieżki
Ubikwityna jest 76-aminokwasowym białkiem, który jest wysoce konserwowany i wszechobecnie wyrażany we wszystkich eukariotach od drożdży do ludzi. Kwas karboksylowy w C-końcowej glicynie ubikwityny może być kowalencyjnie przyłączony do epsilon aminy lizyny na innym białku poprzez wiązanie izopeptydowe. Proces ten nazywany jest „ubikwitynacją”., Co więcej, C-końcowy ogon ubikwityny może być bezpośrednio przyłączony do n-końcowej metioniny innej ubikwityny, tworząc liniowy łańcuch polyubiquitin. Ubikwitynacja odgrywa zasadniczą rolę w regulacji szlaków NF-kB. W komórkach niesymulowanych NF-kB wiąże się z białkami hamującymi rodziny kB (IkB) i jest sekwestrowany w cytoplazmie., Po stymulacji IkB jest fosforylowany przez kompleks kinazy IkB( IKK), Fosforylowany IkB jest następnie ubikwitynowany i rozkładany przez proteasom 26S, umożliwiając w ten sposób NF-kB translokację do jądra, gdzie reguluje ekspresję wielu genów. Jako podjednostkę regulacyjną kompleksu IKK, zaproponowano, że NEMO będzie kluczowym czynnikiem przekazywania sygnału ubikwitynacji do aktywacji IKK. Kilka dubów działa jako kluczowe negatywne regulatory IKK, aby umożliwić ścisłą kontrolę aktywacji NF-kB., Jednym z najlepiej zbadanych DUBs jest A20, zaproponowano, że A20 hamuje hiperaaktywację NFkB przez deubiquitinating K63-linked polyubiquitin attached to RIP1 through the N-terminal OTU domain, as well as promoting K48-linked Polyubiquitination of RIP1 for proteasomal degradation.
4.
NF-kB działa jako centralny mediator odpowiedzi immunologicznych i zapalnych, bierze udział w odpowiedziach stresowych i regulacji proliferacji komórek i apoptozy. Odpowiednie geny docelowe NF-kB pozwalają organizmowi skutecznie reagować na te zmiany środowiskowe., Klasyczny szlak NF-kB jest aktywowany przez różne sygnały zapalne, co powoduje koordynację ekspresji wielu genów zapalnych i wrodzonych immunologicznych. Prozapalne cytokiny IL – 1B i TNF-a aktywują NF-kB, a ich ekspresja jest indukowana w odpowiedzi na aktywację NF-kB, tworząc w ten sposób wzmacniającą pętlę posuwu do przodu. Alternatywna droga dla NF–kB powoduje jądrową translokację dimerów P52-RelB, jest ściśle zależna od homodimerów IKKa i jest aktywowana przez LTbR, BAFF i CD40L przez NIK., Wiele danych silnie sugeruje, że alternatywny szlak odgrywa kluczową rolę w ekspresji genów zaangażowanych w rozwój i utrzymanie wtórnych narządów limfatycznych. Czynniki transkrypcyjne rodziny NF-kB kontrolują ekspresję dużej liczby genów docelowych w odpowiedzi na zmiany w środowisku, pomagając w ten sposób w organizowaniu odpowiedzi zapalnych i immunologicznych.
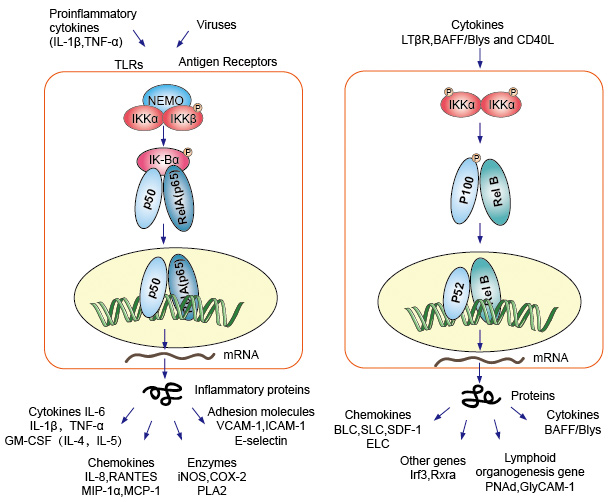
Rysunek 4. Sygnalizacja w dół ścieżki sygnalizacji NF-kB.
5. Związek z chorobami.
- podstawy zapalne chorób metabolicznych.,
szlak sygnałowy IKK / NF-kB jest kluczem do połączenia metabolizmu, stanu zapalnego i działania insuliny. Większość sygnałów stresu metabolicznego powodujących insulinooporność lub dysfunkcję komórek β trzustki, indukowanych przez sygnały wewnątrzkomórkowe lub zewnątrzkomórkowe, zbiegają się na kinazę aktywującą NF-kB IKKb i inne główne kinazy zapalne, kinaza białkowa aktywowana JNK-mitogen (MAPK).
- NF-kB i glikoliza.
glikoliza może wytwarzać ATP w większych ilościach i w szybszym tempie niż fosforylacja oksydacyjna., Glukoza jest zatem niezbędnym składnikiem odżywczym dla nowotworów i normalnych proliferujących komórek. NF-kB koordynuje wiele sygnałów, które napędzają aktywację i proliferację komórek podczas odporności, zapalenia i onkogenezy.
- NF-kB i metabolizm oksydacyjny.
NF-kB reguluje homeostazę energetyczną i adaptację metaboliczną poprzez kontrolowanie równowagi między glikolizą a oddychaniem w celu dostarczania energii. Hamowanie NF-kB / RelA różnymi środkami zmniejszało zużycie tlenu i powodowało przeprogramowanie do glikolizy tlenowej