1. ábra. A kanonikus és nem kanonikus NF-kB jelátviteli útvonal
mi az NF-kB?
az NF-kB az aktivált B-sejtek Atomtényezőjének rövid neve. Ez nem egyetlen fehérje, hanem egy kis indukálható transzkripciós faktor család, amely fontos szerepet játszik szinte minden emlőssejtben. Szabályozza a DNS transzkripciót, a citokintermelést, a sejtek túlélését és egyéb fontos sejtes eseményeket, különösen fontos szerepet játszik a fertőzésre adott immunválasz szabályozásában.
NF-kB molekuláris általában dimerek., Az NF-kB tipikus szerkezete a P50-P65 dimer (NF-kB1/RelA). A dimer képződés szükséges a DNS-kötéshez, két NF-kB monomer kötődik a DNS-hez dimerként. A dimer N-terminális régiói felelősek a specifikus DNS-érintkezésért. A C-terminális régiók általában erősen konzerváltak, felelősek a dimerizációért és a nem specifikus DNS-foszfát érintkezésért. Az egész NF-kB-molekula olyan, mint egy fogó a DNS-láncon, és transzkripciós faktorként működik (2.ábra).
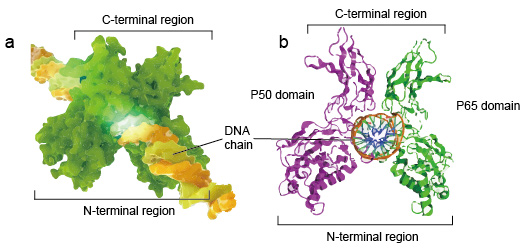
2.ábra. A szerkezet A NF-kB fehérje dimer kötődés DNS lánc.,
NF-kB család
mivel az NF-kB családtagok megosztják a strukturális homológiát a retrovirális onkoprotein V-Rel. tehát NF-kB / Rel fehérjéknek is nevezték. Az emlősökben az NF-kB transzkripciós faktor család 5 fehérjéből áll: p65/RelA, RelB, C-Rel, p105/p50 (NF-kB1) és p100/p52 (NF-kB2). Ezek az 5 fehérje egymással társulnak, és különböző transzkripcionálisan aktív homo / heterodimerikus komplexeket alkotnak (3.ábra). Mindannyian közös megőrzött Rel homológia domain (RHD) 300 aa hosszúságú., Ezeknek az RHD doméneknek több funkciója van, mint például a dimerizáció, a DNS-kötés, az IKB-kkel való kölcsönhatás és a nukleáris transzlokáció. Bár az NF-kB fehérje családtagok akár 15 különböző dimert képezhetnek, de sokan még nem bizonyították. Az NF-kB dimer leggyakoribb formája a P50 / p65 heterodimer, amelyet szinte minden sejttípusban finanszíroztak. Mivel csak a P65/Rel, a RelB és a c-Rel rendelkezik karboxi-terminális transzaktivációs doménekkel (TAD), az NF-kB fehérjecsalád további két csoportra osztható., a P50 és a p52 prekurzor molekulák P105, illetve p100 feldolgozásával jön létre. Ezért a Rel dimerek nem minden kombinációja transzkripcionálisan aktív.
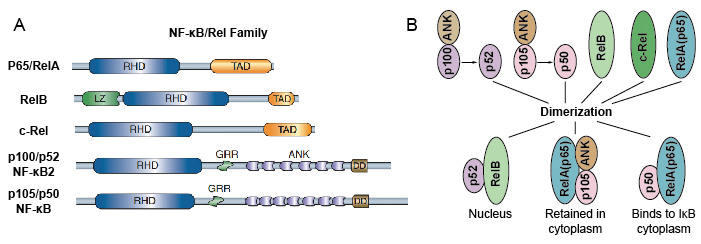
3.ábra. Az 5 fehérje és az NF-kB család homo/heterodimerikus komplexei.
NF-kB jelátviteli útvonal
NF-kB protein dimmerek mint nukleáris transzkripciós faktor, át kell vándorolniuk a magba, DNS-vel kombinálva, hogy működjenek. A legtöbb nyugalmi állapotban lévő normál sejtben az NF-KB inaktív volt, és a citoplazmában maradt., Ezek kötődnek az IK-B protein nevű specifikus inhibitorokhoz, amelyek kötődnek az NF-kB Rel homológiai doménjéhez (RHD), és zavarják a nukleáris lokalizációs szekvencia (NLS) funkcióját. Ezek az inhibitor fehérjék, amelyek közé tartozik az IkBa, az IkBb és az IkBg, 6-7 ankyrin ismétlést tartalmaznak, amelyek közvetítik az RHD-hez való kötődést. Ezek az ismétlések jelen vannak az NF-KB2/p100 és az NF-kB1/p105 prekurzorok C-terminális feleiben is, amelyek IKB-ként is működnek, és partnereiket, a Rel fehérjéket megtartják a citoplazmában., Az NF-kB molekuláris aktiválásához a sejteknek először el kell különíteniük az NF-kB fehérjét az inhibitoroktól. Két fő jelátviteli utak vezetnek az IK-B fehérje gátló disszociációs a NF-kB dimmer, majd hagyja, hogy a transzlokáció az NF-kB dimers a citoplazmában, a mag.
1., Kanonikus/klasszikus kaszkád
kanonikus vagy klasszikus kaszkádjelzés a pro-gyulladásos citokinek sejtfelszíni receptorából és a kórokozóval összefüggő molekuláris mintákból (Pamp), például a tumor nekrózis faktor receptorból (TNFR), toll-szerű receptorból (TLR) és T/B sejtreceptorból kiindulva. Ezek a receptorok kötődnek a ligandum molekuláikhoz, és továbbítják a jelet a sejtmembránon keresztül, az IkB kináz (IKK) komplex aktiválódását okozzák. Ennek a komplexnek a leggyakoribb formája az IKKa és IKKß alegységek heterodimerje,valamint egy IKKy szabályozási alegység., Az IKKy egység is nevezik NEMO NF-kB essential modulator. Az aktivált IKK komplex, elsősorban keresztül ható IKKß egy IKKy-függő módon, katalizálja a mőszer a IkBs (helyszíneken egyenértékű Ser32, valamint Ser36 a IkBa), polyubiquitination (helyszíneken egyenértékű Lys21, valamint Lys22 a IkBa), valamint a későbbi lebontás által a 26S proteaszóma. A felszabadult NF-kB dimerek( leggyakrabban a p50-RelA dimer), a sejtmagba transzlálnak, megkötik a DNS-t és aktiválják a down-stream gén transzkripciót.
2., Nem kanonikus / alternatív útvonal kaszkád
egy másik NF-kB aktiváló út, amelyet nem kanonikus vagy alternatív útvonalnak neveznek. Ez az út független IKKß és IKKy, de függ IKKa dimmer helyett. A jelátvitel a citoplazmába az LT-β vagy BAFF receptoron keresztül történik. Foszfonát A NIK fehérje, NIK fehérje, majd foszfonát az IKKa homodimmers. Az IKKa homodimerek célja ezen az úton az NF-kB2/p100, amelyet két C-terminális helyen foszforilálnak., Ezeknek a helyeknek a foszforilációja elengedhetetlen a P100 P52-re történő feldolgozásához, amely szintén függ a poliubikvitinációtól és a proteaszomális lebomlástól. Azonban ahelyett, hogy vezető teljes p100 lebomlás, mint látható IkBs, a foszforiláció-függő jelen kutatás célja annak felderítése, a p100 eredmények csak a bomlás a gátló C-terminális fele része. Miután a C-terminál fele lebomlik, felszabadul az NF-kB N-terminális része (az RHD-t tartalmazó p52 polipeptid)., Mivel a P100 RHD-je leggyakrabban RelB-vel társul, ennek az “alternatív” útnak az aktiválása a P52–RelB dimerek nukleáris transzlokációját eredményezi. A dimer végül kötődik a DNS-hez és aktiválja a down-stream gén transzkripciót.
3. Pathway regulation
Ubiquitin egy 76-aminosav fehérje, amely erősen konzervált és mindenütt kifejezett minden eukariótában élesztőtől emberig. Az ubiquitin C-terminális glicinjében lévő karbonsav kovalensen kapcsolódhat a lizin epszilon-aminjához egy másik fehérjén izopeptidkötésen keresztül. Ezt a folyamatot “ubiquitinációnak”nevezik., Ezenkívül az ubiquitin C-terminális farka közvetlenül csatlakoztatható egy másik ubiquitin N-terminális metioninjához, hogy lineáris poliubikitin láncot képezzen. Az ubiquitináció alapvető szerepet játszik az NF-kB útvonalak szabályozásában. A nem stimulált sejtekben az NF-kB a kB család (IkB) gátló fehérjéihez kötődik, és a citoplazmában szekvesztálódik., Amikor stimuláció, az IkB az phosphorylated az IkB-kináz (IKK) komplex, Phosphorylated IkB ezt követően ubiquitinated pedig megalázza 26S proteaszóma, így lehetővé teszi az NF-kB, hogy translocate, hogy az atommag, ahol szabályozza a kifejezés nagyszámú gén. Mivel a szabályozási alegysége az IKK komplex, NEMO javasolták, hogy a legfontosabb tényező a transzducing ubiquitination jel IKK aktiválás. Számos DUBs az IKK kulcsfontosságú negatív szabályozójaként működik, hogy lehetővé tegye az NF-kB aktiválás szoros ellenőrzését., Az egyik legjobban tanulmányozott DUBs az A20, azt javasolták, hogy az A20 elnyomja az NFkB hiperaktiválását azáltal, hogy a RIP1-hez csatolt K63-kapcsolt poliubiquitint az N-terminális OTU doménen keresztül deubiquitinálja, valamint elősegíti a RIP1 K48-hoz kapcsolódó poliubiquitinációját a proteaszomális lebomáció érdekében.
4. Downstream jelzés
az NF-kB az immunválaszok és a gyulladásos reakciók központi közvetítőjeként működik, és részt vesz a stresszválaszokban, valamint a sejtproliferáció és az apoptózis szabályozásában. A megfelelő NF-kB célgének lehetővé teszik a szervezet számára, hogy hatékonyan reagáljon ezekre a környezeti változásokra., A klasszikus NF-kB-utat számos gyulladásos jel aktiválja, ami több gyulladásos és veleszületett immungén koordinált expresszióját eredményezi. A proinflammatorikus citokinek IL-1B és TNF-a aktiválják az NF-kB-t, és expressziójuk az NF-kB aktivációra adott válaszként indukálódik, ezáltal erősítő előtolási hurkot képezve. Az NF-kB alternatív útvonala a P52-RelB dimerek nukleáris transzlokációját eredményezi, szigorúan az IKKa homodimerektől függ, és az LTbR, a BAFF és a CD40L aktiválja a NIK., Számos adat arra utal, hogy az alternatív út központi szerepet játszik a másodlagos limfoid szervek fejlődésében és fenntartásában részt vevő gének expressziójában. Az NF-kB család transzkripciós faktorai a környezet változásaira adott válaszként nagyszámú célgén expresszióját szabályozzák, ezáltal elősegítve a gyulladásos és immunválaszok kialakulását.
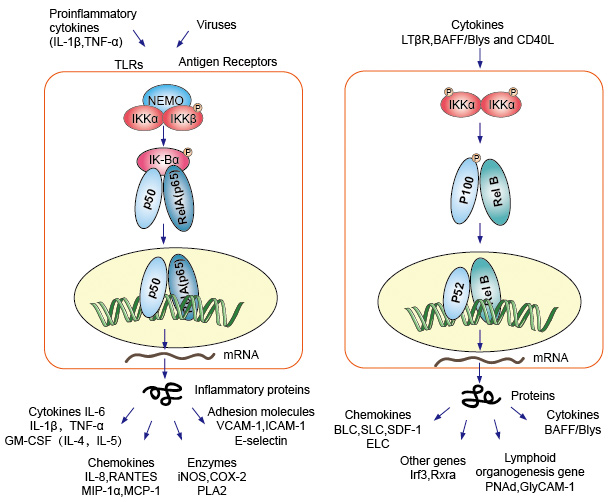
4.ábra. Az NF-kB jelátviteli útvonal Down-stream jelzése.
5. Kapcsolat a betegségekkel.
- az anyagcsere-betegségek gyulladásos alapja.,
az IKK / NF-kB jelátviteli út kulcsfontosságú az anyagcsere, a gyulladás és az inzulinhatás összekapcsolásához. Az inzulinrezisztenciát vagy pancreas β-sejt diszfunkciót eredményező metabolikus stresszjelek többsége, akár intracelluláris, akár extracelluláris jelek által kiváltott, az NF-kB-aktiváló kináz IKKb-re és más jelentős gyulladásos kinázra, a JNK-mitogén aktivált protein kinázra (MAPK) konvergál.
- NF-kB és glikolízis.
A glikolízis az oxidatív foszforilációnál nagyobb mennyiségben és gyorsabban képes ATP-t termelni., A glükóz ezért nélkülözhetetlen tápanyag a rák és a normális proliferáló sejtek számára. Az NF-kB számos olyan jelet koordinál, amelyek a sejtek aktiválódását és proliferációját okozzák az immunitás, a gyulladás és az onkogenezis során.
- NF-kB és oxidatív metabolizmus.
NF-kB szabályozza az energia homeosztázist és a metabolikus alkalmazkodást azáltal, hogy szabályozza a glikolízis és a légzés közötti egyensúlyt az energiaellátás érdekében. Az NF-kB/RelA gátlása különböző módon csökkentette az oxigénfogyasztást, és aerob glikolízisre átprogramozást okozott