Abbildung 1. Der kanonische und nicht-kanonische NF-kB-Signalweg
Was ist NF-kB?
NF-kB ist ein kurzer name, der von Nuclear Factor kappa-light-chain-enhancer von aktivierten B-Zellen. Es ist kein einziges Protein, sondern eine kleine Familie induzierbarer Transkriptionsfaktoren, die in fast allen Säugetierzellen eine wichtige Rolle spielen. Es kontrolliert die DNA-Transkription, die Zytokinproduktion, das Zellüberleben und andere wichtige Zellereignisse und spielt insbesondere eine Schlüsselrolle bei der Regulierung der Immunantwort auf Infektionen.
NF-kB Moleküle sind in der Regel Dimere., Eine typische Struktur von NF-kB ist P50-P65 Dimer (NF-kB1/RelA). Die Dimerbildung ist für die DNA-Bindung notwendig, zwei NF-kB-Monomere binden als Dimer an DNA. Die N-terminalen Regionen von Dimer sind für den spezifischen DNA-Kontakt verantwortlich. Die C-terminalen Regionen sind in der Regel stark konserviert, sie sind für die Dimerisation und den unspezifischen DNA-Phosphatkontakt verantwortlich. Das gesamte NF-kB-Molekül ist wie ein Schraubstock an der DNA-Kette und fungiert als Transkriptionsfaktor (Abbildung 2).
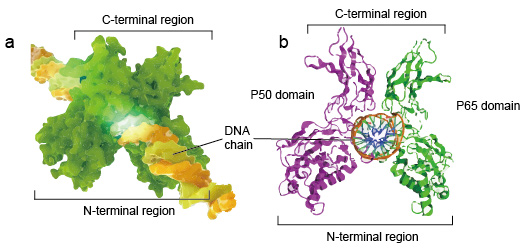
Abbildung 2. Die Struktur der NF-kB-Protein-Dimer-Bindung mit DNA-Kette.,
NF-kB-Familie
Weil NF-kB-Familienmitglieder strukturelle Homologie mit dem retroviralen Oncoprotein v-Rel teilen. so nannten sie auch NF-kB / Rel-Proteine. Die NF-kB-Transkriptionsfaktorfamilie bei Säugetieren besteht aus 5 Proteinen: p65 / RelA, RelB, c-Rel, p105/p50 (NF-kB1) und p100/p52 (NF-kB2). Diese 5 Proteine assoziieren miteinander und bilden unterschiedliche transkriptionell aktive homo / heterodimere Komplexe (Abbildung 3). Sie alle teilen eine gemeinsame konservierte Rel-Homologiedomäne (RHD) von 300 aa Länge., Diese RHD-Domäne hat mehrere Funktionen wie Dimerisierung, DNA-Bindung, Interaktion mit IkBs und nukleare Translokation. Obwohl die Mitglieder der NF-kB-Proteinfamilie bis zu 15 verschiedene Dimere bilden können, haben viele von ihnen noch nicht nachgewiesen. Die am häufigsten vorkommende Form des NF-kB-Dimers ist das Heterodimer p50/p65, das in fast allen Zelltypen nachgewiesen wurde. Da nur P65 / Rel, RelB und c-Rel carboxy-terminale Transaktionsdomänen (TAD) aufweisen, kann die NF-kB-Proteinfamilie weiter in zwei Gruppen unterteilt werden., p50 und p52 werden durch Verarbeitung der Vorläufermoleküle p105 bzw. Daher sind nicht alle Kombinationen von Rel-Dimeren transkriptional aktiv.
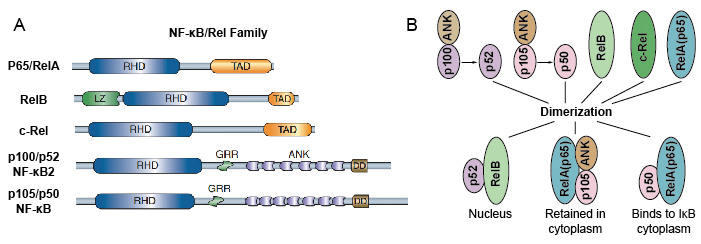
Abbildung 3. Das 5-Protein und ihre homo/heterodimeren Komplexe der NF-kB-Familie.
NF-kB Signalweg
NF-kB Proteindimmer als nuklearer Transkriptionsfaktor müssen sie in den Kern wandern, kombiniert mit DNA, um Funktion zu haben. In den meisten Typen der normalen Zellen im Ruhezustand war NF-KB inaktiv und blieb im Zytoplasma., Sie binden an ein spezifisches Inhibitor namens IK-B-Protein, das an die Rel-Homologiedomäne (RHD) von NF-kB binden und seine Nuclear Localization Sequence (NLS) – Funktion stören könnte. Diese Inhibitorproteine, zu denen IkBa, IkBb und IkBg gehören, enthalten 6-7 Ankyrin-Wiederholungen, die die Bindung an die RHD vermitteln. Diese Wiederholungen sind auch in den C-terminalen Hälften der Vorläufer NF-kB2/p100 und NF-kB1/p105 vorhanden, die ebenfalls als IkBs fungieren und ihre Partner, die Rel-Proteine, im Zytoplasma behalten., Um das NF-kB-Molekül zu aktivieren, müssen die Zellen zuerst das NF-kB-Protein von ihren Inhibitoren trennen. Es gibt zwei Hauptsignalwege, die zur Dissoziation des IK-B-Proteininhibitors vom NF-kB-Dimmer führen und die Translokation von NF-kB-Dimeren aus dem Zytoplasma in den Kern ermöglichen.
1., Kanonische / klassische Kaskade
Kanonische oder klassische Kaskadensignalisierung ausgehend vom Zelloberflächenrezeptor von proinflammatorischen Zytokinen und pathogenassoziierten molekularen Mustern (PAMPs) wie dem Tumornekrosefaktorrezeptor (TNFR), dem Toll-Like-Rezeptor (TLR) und dem T/B-Zell-Rezeptor. Diese Rezeptoren, die mit ihren Ligandenmolekülen binden und das Signal über die Zellmembran übertragen, bewirken die Aktivierung des IkB-Kinase (IKK) – Komplexes. Die häufigste Form dieses Komplexes besteht aus Heterodimer von IKKa-und IKKß-katalytischen Untereinheiten und einer IKKy-regulatorischen Untereinheit., Die IKKy einheit auch als NEMO für NF-kB ätherisches modulator. Der aktivierte IKK-Komplex, der überwiegend IKKß-abhängig wirkt, katalysiert die Phosphorylierung von IkBs (an Stellen, die Ser32 und Ser36 von IkBa entsprechen), Polyubiquitination (an Stellen, die Lys21 und Lys22 von IkBa entsprechen) und anschließenden Abbau durch das 26S-Proteasom. Die freigesetzten NF-kB-Dimer (am häufigsten das p50–RelA-Dimer) translozieren sich in den Kern, binden DNA und aktivieren die Down-Stream-Gen-Transkription.
2., Nicht-kanonischer / alternativer Weg Kaskade
Ein weiterer NF-kB aktivierender Weg, der als nicht-kanonischer oder alternativer Weg bezeichnet wird. Dieser Weg ist unabhängig von IKKß und IKKy, sondern abhängig von IKKa Dimmer statt. Die Signalübertragung in das Zytoplasma durch den LT-β – oder BAFF-Rezeptor. Phosphonat ein NIK-Protein, NIK-Protein Phosphonat dann die IKKa Homodimmer. Das Ziel für IKKa-Homodimer in diesem Weg ist NF-kB2 / p100, das an zwei C-terminalen Stellen phosphoryliert wird., Die Phosphorylierung dieser Stellen ist für die p100-Verarbeitung zu p52 unerlässlich, was ebenfalls von Polyubiquitination und proteasomalem Abbau abhängt. Anstatt jedoch, wie bei IkBs gesehen, zu einem vollständigen p100-Abbau zu führen, führt die phosphorylierungsabhängige Ubiquitination von p100 nur zum Abbau seiner inhibitorischen C-terminalen Halbteile. Sobald die C-terminale Hälfte abgebaut ist, wird der N-terminale Teil von NF-kB (das p52-Polypeptid, das die RHD enthält) freigesetzt., Da die RHD von p100 am häufigsten mit RelB assoziiert ist, führt die Aktivierung dieses „alternativen“ Weges zur nuklearen Translokation von p52–RelB-Dimeren. Das Dimer bindet schließlich an DNA und aktiviert die Down-Stream-Gen-Transkription.
3. Wegregulierung
Ubiquitin ist ein 76-Aminosäure-Protein, das in allen Eukaryoten von Hefe bis Mensch stark konserviert und ubiquitär exprimiert wird. Die Carbonsäure im C-terminalen Glycin von Ubiquitin kann durch eine Isopeptidbindung kovalent an das Epsilonamin von Lysin auf einem anderen Protein gebunden werden. Dieser Prozess wird „Ubiquitination“genannt., Darüber hinaus kann der C-terminale Schwanz von Ubiquitin direkt an das N-terminale Methionin eines anderen Ubiquitins gebunden werden, um eine lineare Polyubiquitinkette zu bilden. Die Ubiquitination spielt eine wesentliche Rolle bei der Regulierung von NF-kB-Pfaden. In unstimulierten Zellen bindet NF-kB an inhibitorische Proteine der kB-Familie (IkB) und wird im Zytoplasma sequestriert., Bei der Stimulation wird IkB durch den IkB-Kinase (IKK) – Komplex phosphoryliert, phosphoryliert IkB wird anschließend ubiquitiniert und durch 26S-Proteasom abgebaut, wodurch NF-kB in den Kern transloziert werden kann, wo es die Expression einer Vielzahl von Genen reguliert. Als regulatorische Untereinheit des IKK-Komplexes wurde vorgeschlagen, dass NEMO der Schlüsselfaktor für die Übertragung des Ubiquitinationssignals auf die IKK-Aktivierung ist. Mehrere DUBs fungieren als wichtige negative Regler der IKK, um eine enge Steuerung der NF-kB-Aktivierung zu ermöglichen., Eines der am besten untersuchten DUBs ist A20, Es wurde vorgeschlagen, dass A20 die Hyperaktivierung von NFkB durch Deubiquitination von K63-verbundenem Polyubiquitin, das über die N-terminale OTU-Domäne an RIP1 gebunden ist, unterdrücken und die K48-verknüpfte Polyubiquitination von RIP1 für den proteasomalen Abbau fördern.
4. Downstream Signaling
NF-kB wirkt als zentraler Mediator von Immun – und Entzündungsreaktionen und ist an Stressreaktionen und der Regulation der Zellproliferation und Apoptose beteiligt. Die jeweiligen NF-kB-Zielgene ermöglichen es dem Organismus, effektiv auf diese Umweltveränderungen zu reagieren., Der klassische NF-kB-Weg wird durch eine Vielzahl von Entzündungssignalen aktiviert, was zur Koordinatenexpression mehrerer entzündlicher und angeborener Immungene führt. Die proinflammatorischen Zytokine IL-1b und TNF-a aktivieren NF-kB, und ihre Expression wird als Reaktion auf die NF-kB-Aktivierung induziert, wodurch eine amplifizierende Feed-Forward-Schleife gebildet wird. Der alternative Weg für NF-kB führt zur nuklearen Translokation von p52-RelB-Dimeren, ist streng abhängig von IKKa-Homodimern und wird von LTbR, BAFF und CD40L von NIK aktiviert., Viele Daten deuten stark darauf hin, dass der alternative Weg eine zentrale Rolle bei der Expression von Genen spielt, die an der Entwicklung und Aufrechterhaltung sekundärer lymphatischer Organe beteiligt sind. Die Transkriptionsfaktoren der NF-kB-Familie steuern die Expression einer großen Anzahl von Zielgenen als Reaktion auf Veränderungen in der Umwelt und helfen so, Entzündungs-und Immunantworten zu orchestrieren.
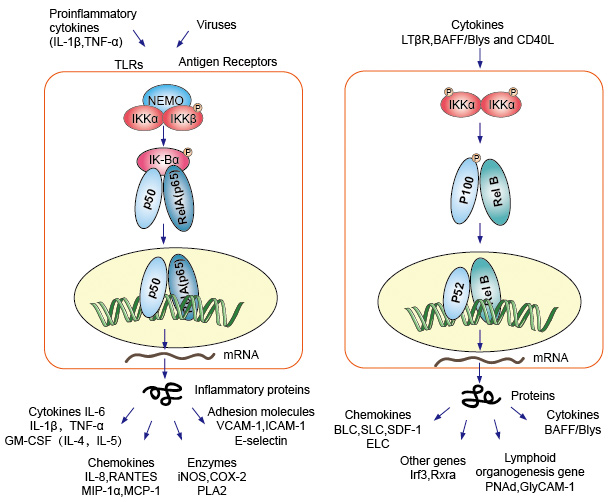
Abbildung 4. Down-Stream-Signalisierung des NF-kB-Signalwegs.
5. Beziehung zu Krankheiten.
- Die entzündliche Basis von Stoffwechselerkrankungen.,
Der IKK / NF-kB-Signalweg ist der Schlüssel zur Verknüpfung von Stoffwechsel, Entzündung und Insulinwirkung. Die meisten metabolischen Stresssignale, die zu Insulinresistenz oder Pankreas-β-Zellfunktionsstörungen führen, unabhängig davon, ob sie durch intrazelluläre oder extrazelluläre Signale induziert werden, konvergieren auf der NF-kB-aktivierenden Kinase IKKb und anderer wichtiger entzündlicher Kinase, der JNK-Mitogen-aktivierten Proteinkinase (MAPK).
- NF-kB und die Glykolyse.
Die Glykolyse kann ATP in größeren Mengen und schneller erzeugen als die oxidative Phosphorylierung., Glukose ist daher ein essentieller Nährstoff für Krebs und normale proliferierende Zellen. NF-kB koordiniert viele der Signale, die die Zellaktivierung und-proliferation während der Immunität, Entzündung und Onkogenese antreiben.
- NF-kB und oxidativen Stoffwechsel.
NF-kB regelt die Energiehomöostase und Stoffwechselanpassung, indem es das Gleichgewicht zwischen Glykolyse und Atmung für die Energieversorgung steuert. Die Hemmung von NF-kB / RelA durch verschiedene Mittel verringerte den Sauerstoffverbrauch und verursachte eine Neuprogrammierung zur aeroben Glykolyse