Figure 1. La voie de signalisation canonique et non canonique NF-kB
qu’est-ce que NF-kB?
NF-kB est un nom abrégé du facteur nucléaire KAPPA-activateur de chaîne légère des cellules B activées. Ce n’est pas une seule protéine, mais une petite famille de facteurs de transcription inductibles qui jouent un rôle important dans presque toutes les cellules de mammifères. Il contrôle la transcription de l’ADN, la production de cytokines, la survie cellulaire et d’autres événements cellulaires importants, en particulier jouent un rôle clé dans la régulation de la réponse immunitaire à l’infection.
Les NF-kB moléculaires sont généralement des dimères., Une structure typique de NF-kB est le dimère P50-P65 (NF-kB1/RelA). La formation de dimères est nécessaire pour la liaison à l’ADN, deux monomères NF-kB se lient à L’ADN en tant que dimère. Les régions n-terminales du dimère sont responsables du contact spécifique de L’ADN. Les régions C-terminales sont généralement hautement conservées, elles sont responsables de la dimérisation et du contact non spécifique avec le phosphate D’ADN. L’ensemble moléculaire NF-kB est comme un étau de pince sur la chaîne D’ADN et fonctionne comme un facteur de transcription (figure 2).
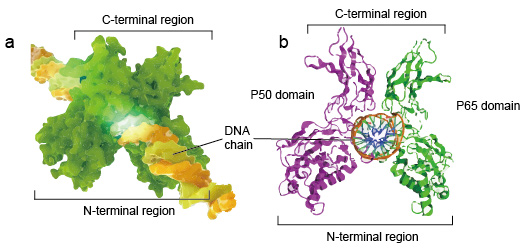
la Figure 2. La structure de la liaison du dimère de protéine NF-kB avec la chaîne D’ADN.,
famille NF-kB
parce que les membres de la famille NF-kB partagent une homologie structurelle avec l’oncoprotéine rétrovirale v-Rel. ils ont donc également appelé les protéines NF-kB/Rel. La famille des facteurs de transcription NF-kB chez les mammifères se compose de 5 protéines: p65 / RelA, RelB, c-Rel, p105/p50 (NF-kB1) et p100/p52 (NF-kB2). Ces 5 protéines s’associent entre elles et forment des complexes homo/hétérodimériques transcriptionnellement actifs distincts (Figure 3). Ils partagent tous un domaine d’homologie rel conservé commun (RHD) de longueur 300 aa., Ces domaines RHD ont de multiples fonctions telles que la dimérisation, la liaison à l’ADN, l’interaction avec les IkBs et la translocation nucléaire. Bien que les membres de la famille de protéines NF-kB peuvent former jusqu’à 15 dimères différents, mais beaucoup d’entre eux n’a pas encore démontré. La forme la plus abondante de dimère NF-kB est l’hétérodimère p50/p65 qui a été utilisé dans presque tous les types de cellules. Comme seuls P65 / Rel, RelB et c-Rel ont des domaines de transactivation carboxy-terminale (TAD), la famille de protéines NF-kB peut être divisée en deux groupes., p50 et p52 sont générés par le traitement des molécules précurseurs p105 et P100, respectivement. Par conséquent, toutes les combinaisons de dimères Rel ne sont pas transcriptionnellement actives.
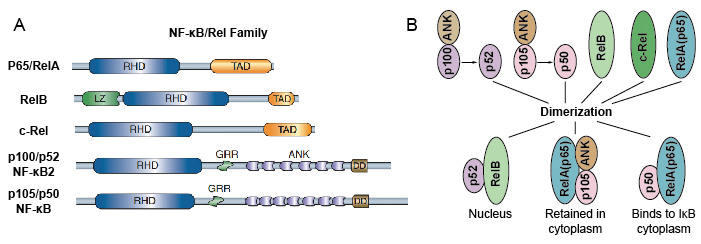
la Figure 3. La protéine 5 et leurs complexes homo / hétérodimériques de la famille NF-kB.
voie de signalisation NF-kB
variateurs de protéines NF-kB en tant que facteur de transcription nucléaire, ils doivent migrer vers le noyau, combinés à L’ADN pour fonctionner. Dans la plupart des types de cellules normales à l’état de repos, NF-KB était inactif et se maintenait dans le cytoplasme., Ils se lient à un inhibiteur spécifique appelé protéine IK-B, qui pourrait se lier au domaine d’homologie Rel (RHD) de NF-kB et interférer avec sa fonction de séquence de localisation nucléaire (NLS). Ces protéines inhibitrices, qui comprennent IkBa, IkBb et IkBg, contiennent 6-7 répétitions d’ankyrine qui médient la liaison à la RHD. Ces répétitions sont également présentes dans les moitiés C-terminales des précurseurs NF-kB2/p100 et NF-kB1/p105, qui fonctionnent également comme IkBs et conservent leurs partenaires, les protéines Rel, dans le cytoplasme., Afin d’activer la molécule NF-kB, les cellules doivent d’abord séparer la protéine NF-kB de leurs inhibiteurs. Il y a deux voies de signalisation principales mènent à la dissociation d’inhibiteur de protéine D’IK-B du gradateur de NF-kB et laissent la translocation des dimères de NF-kB du cytoplasme dans le noyau.
1., Cascade canonique / classique
signalisation en cascade canonique ou classique à partir du récepteur de surface cellulaire des cytokines pro-inflammatoires et des modèles moléculaires associés aux agents pathogènes (Pamp) tels que le récepteur du facteur de nécrose tumorale (TNFR), le récepteur toll-like (TLR) et le récepteur des cellules T / B. Ces récepteurs se liant à leurs molécules de ligand et transfèrent le signal à travers la membrane cellulaire, provoquent l’activation du complexe IkB kinase (IKK). La forme la plus courante de ce complexe est constituée d’hétérodimères de sous-unités catalytiques IKKa et IKKß et d’une sous-unité régulatrice IKKy., L’Unité IKKy également appelée NEMO pour NF-kB essential modulator. Le complexe IKK activé, agissant principalement par IKKß D’une manière IKKy-dépendante, catalyse la phosphorylation D’IkBs (aux sites équivalents à Ser32 et Ser36 d’IkBa), la polyubiquitination (aux sites équivalents à Lys21 et Lys22 d’IkBa) et la dégradation subséquente par le protéasome 26S. Les dimères NF-kB libérés (le plus souvent le dimère p50–RelA), se transfèrent vers le noyau, lient L’ADN et activent la transcription du gène en aval.
2., Cascade de voies non canoniques/alternatives
Une autre voie d’activation NF-kB appelée voie non canonique ou alternative. Cette voie est indépendante de IKKß et IKKy, mais dépend du variateur IKKa à la place. Le transfert de signalisation dans le cytoplasme à travers le récepteur LT-β ou BAFF. Phosphonate une protéine NIK, protéine NIK puis phosphonate les homodimères IKKa. La cible pour les homodimères IKKa dans cette voie est NF-kB2 / p100, qui est phosphorylé à deux sites C-terminaux., La Phosphorylation de ces sites est essentielle pour le traitement de p100 en p52, qui dépend également de la polyubiquitination et de la dégradation protéasomale. Cependant, au lieu de conduire à une dégradation complète de p100, comme on le voit avec IkBs, l’ubiquitination dépendante de la phosphorylation de p100 n’entraîne que la dégradation de ses demi-parties C-terminales inhibitrices. Une fois que la moitié C-terminale est dégradée, la partie N-terminale de NF-kB (le polypeptide p52 qui contient le RHD) est libérée., Comme le RHD de p100 est le plus souvent associé à RelB, l’activation de cette voie « alternative » entraîne la translocation nucléaire des dimères p52–RelB. Le dimère se lie finalement à L’ADN et active la transcription du gène en aval.
3. Régulation des voies
L’ubiquitine est une protéine de 76 acides aminés hautement conservée et exprimée de manière ubiquitaire chez tous les eucaryotes, de la levure à l’homme. L’acide carboxylique dans la glycine C-terminale de l’ubiquitine peut être fixé de manière covalente à l’amine epsilon de la lysine sur une autre protéine par une liaison isopeptidique. Ce processus est appelé « ubiquitination »., De plus, la queue C-terminale de l’ubiquitine peut être directement attachée à la méthionine N-terminale d’une autre ubiquitine pour former une chaîne linéaire de polyubiquitine. L’Ubiquitination joue un rôle essentiel dans la régulation des voies NF-kB. Dans les cellules non stimulées, le NF-kB se lie aux protéines inhibitrices de la famille kB (IkB) et est séquestré dans le cytoplasme., Lors de la stimulation, IkB est phosphorylé par le complexe IkB kinase (IKK), IkB phosphorylé est ensuite ubiquitiné et dégradé par le protéasome 26S, permettant ainsi à NF-kB de se déplacer vers le noyau, où il régule l’expression d’une pléthore de gènes. En tant que sous-unité régulatrice du complexe IKK, NEMO a été proposé pour être le facteur clé pour la transduction du signal d’ubiquitination à L’activation IKK. Plusieurs DUBs fonctionnent comme des régulateurs négatifs clés D’IKK pour permettre un contrôle serré de l’activation de NF-kB., L’un des DUBs les mieux étudiés est A20, il a été proposé que A20 supprime l’hyperactivation de NFkB en deubiquitinant la polyubiquitine liée à K63 attachée à RIP1 à travers le domaine OTU N-terminal, ainsi que la promotion de la polyubiquitination liée à K48 de RIP1 pour la dégradation protéasomale.
4. La signalisation en aval
NF-kB agit comme médiateur central des réponses immunitaires et inflammatoires, et est impliquée dans les réponses au stress et la régulation de la prolifération cellulaire et de l’apoptose. Les gènes cibles NF-kB respectifs permettent à l’organisme de réagir efficacement à ces changements environnementaux., La voie classique NF-kB est activée par une variété de signaux inflammatoires, ce qui entraîne l’expression coordonnée de plusieurs gènes immunitaires inflammatoires et innés. Les cytokines proinflammatoires IL – 1B et TNF-a activent NF-kB, et leur expression est induite en réponse à l’activation de NF-kB, formant ainsi une boucle d’avance amplifiante. La voie alternative pour NF-kB entraîne la translocation nucléaire des dimères p52–RelB, dépend strictement des homodimères IKKa et est activée par LTbR, BAFF et CD40L par NIK., De nombreuses données suggèrent fortement que la voie alternative joue un rôle central dans l’expression des gènes impliqués dans le développement et le maintien des organes lymphoïdes secondaires. Les facteurs de transcription de la famille NF-kB contrôlent l’expression d’un grand nombre de gènes cibles en réponse aux changements de l’environnement, aidant ainsi à orchestrer les réponses inflammatoires et immunitaires.
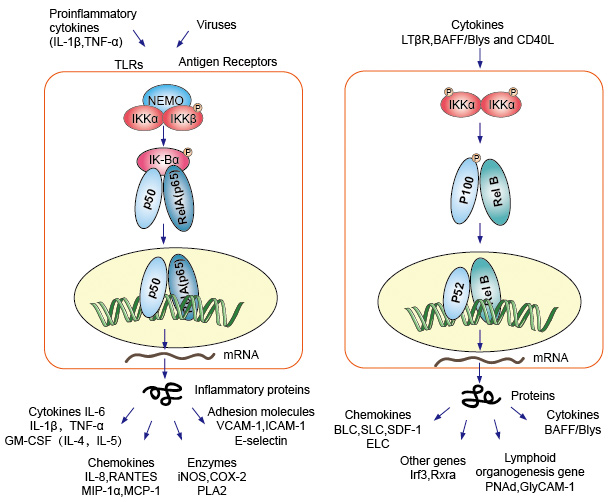
la Figure 4. Signalisation en aval de la voie de signalisation NF-kB.
5. Relation avec les maladies.
- La base inflammatoire des maladies métaboliques.,
la voie de signalisation IKK/NF-kB est la clé de la liaison du métabolisme, de l’inflammation et de l’action de l’insuline. La plupart des signaux de stress métabolique entraînant une résistance à l’insuline ou un dysfonctionnement des cellules β pancréatiques, induits par des signaux intracellulaires ou extracellulaires, convergent vers la kinase activant NF-kB IKKb et une autre kinase inflammatoire majeure, la protéine kinase activée par le JNK-mitogène (MAPK).
- NF-kB et glycolyse.
la glycolyse peut générer de l’ATP en plus grande quantité et à un rythme plus rapide que la phosphorylation oxydative., Le Glucose est donc un nutriment essentiel pour le cancer et les cellules proliférantes normales. NF-kB coordonne de nombreux signaux qui stimulent l’activation et la prolifération des cellules pendant l’immunité, l’inflammation et l’oncogenèse.
- NF-kB et métabolisme oxydatif.
le NF-kB régit l’homéostasie énergétique et l’adaptation métabolique en contrôlant l’équilibre entre la glycolyse et la respiration pour la fourniture d’énergie. L’Inhibition de NF-kB / RelA par divers moyens a diminué la consommation d’oxygène et a provoqué une reprogrammation en glycolyse aérobie