Figura 1. La via di segnalazione NF-kB canonica e non canonica
Che cos’è NF-kB?
NF-kB è un breve nome di Fattore nucleare kappa-light-chain-enhancer di cellule B attivate. Non è una singola proteina, ma una piccola famiglia di fattori di trascrizione inducibili che svolgono un ruolo importante in quasi tutte le cellule di mammifero. Controlla la trascrizione del DNA, la produzione di citochine, la sopravvivenza cellulare e altri importanti eventi cellulari, in particolare svolgono un ruolo chiave nella regolazione della risposta immunitaria alle infezioni.
NF-kB molecolari sono di solito dimeri., Una struttura tipica di NF-kB è P50-P65 dimero (NF-kB1/RelA). La formazione del dimero è necessaria per il legame del DNA, due monomeri NF-kB si legano al DNA come dimero. Le regioni N-terminali del dimero sono responsabili del contatto specifico del DNA. Le regioni C-terminali sono solitamente altamente conservate, sono responsabili della dimerizzazione e del contatto non specifico del fosfato del DNA. L’intero NF-kB molecolare è proprio come una morsa di pinze sulla catena del DNA e funziona come un fattore di trascrizione (figura 2).
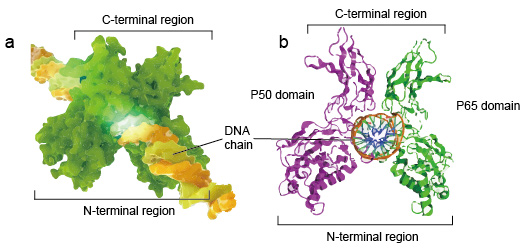
Figura 2. La struttura del legame del dimero proteico NF-kB con la catena del DNA.,
Famiglia NF-kB
Perché i membri della famiglia NF-kB condividono l’omologia strutturale con l’oncoproteina retrovirale v-Rel. così hanno anche chiamato proteine NF-kB/Rel. La famiglia di fattori di trascrizione NF-kB nei mammiferi è composta da 5 proteine: p65/RelA, RelB, c-Rel, p105/p50 (NF-kB1) e p100 / p52 (NF-kB2). Queste 5 proteine si associano tra loro e formano distinti complessi omo/eterodimerici trascrizionalmente attivi (Figura 3). Tutti condividono un dominio di omologia Rel conservato comune (RHD) di lunghezza 300 aa., Questi domini RHD hanno molteplici funzioni come la dimerizzazione, il legame del DNA, l’interazione con IkBs e la traslocazione nucleare. Anche se i membri della famiglia di proteine NF-kB possono formare fino a 15 dimeri diversi, ma molti di loro non hanno ancora dimostrato. La forma più abbondante di dimero NF-kB è l’eterodimero p50 / p65 che è stato utilizzato in quasi tutti i tipi di cellule. Poiché solo P65 / Rel, RelB e c-Rel hanno domini di transattivazione carbossi-terminale (TAD), la famiglia di proteine NF-kB può essere ulteriormente divisa in due gruppi., p50 e p52 sono generati dall’elaborazione delle molecole precursori p105 e p100, rispettivamente. Pertanto, non tutte le combinazioni di dimeri Rel sono trascrizionalmente attive.
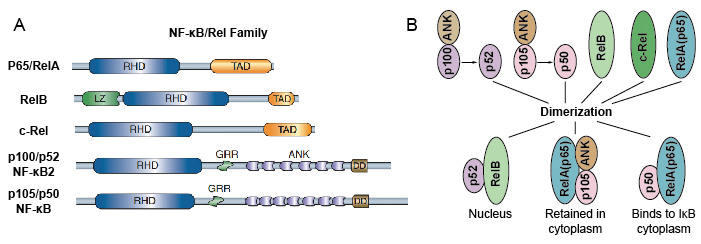
Figura 3. La proteina 5 e i loro complessi omo / eterodimerici della famiglia NF-kB.
NF-kB signaling pathway
NF-kB protein dimmer come fattore di trascrizione nucleare, hanno bisogno di migrare verso il nucleo, combinato con il DNA per avere funzione. Nella maggior parte dei tipi di cellule normali in stato di riposo, NF-KB era inattivo e si trattiene nel citoplasma., Si legano a inibitori specifici chiamati proteina IK-B, che potrebbero legarsi al dominio di omologia Rel (RHD) di NF-kB e interferire con la sua funzione di sequenza di localizzazione nucleare (NLS). Queste proteine inibitrici, che includono IkBa, IkBb e IkBg, contengono 6-7 ripetizioni di ankyrin che mediano il legame con il RHD. Queste ripetizioni sono presenti anche nelle metà C-terminali dei precursori NF-kB2/p100 e NF-kB1/p105, che funzionano anche come IkBs e mantengono i loro partner, le proteine Rel, nel citoplasma., Per attivare il molecolare NF-kB, le cellule devono prima separare la proteina NF-kB dai loro inibitori. Ci sono due principali vie di segnalazione che portano alla dissociazione dell’inibitore della proteina IK-B dal dimmer NF-kB e lasciano che la traslocazione dei dimeri NF-kB dal citoplasma nel nucleo.
1., Cascata Canonica/Classica
Segnalazione a cascata canonica o classica a partire dal recettore di superficie cellulare delle citochine proinfiammatorie e dei pattern molecolari patogeni associati (PAMPs) come il recettore del fattore di necrosi tumorale (TNFR), il recettore toll-like (TLR) e il recettore delle cellule T / B. Questi recettori che si legano con le loro molecole di ligando e trasferiscono il segnale attraverso la membrana cellulare, causano l’attivazione del complesso IKB chinasi (IKK). La forma più comune di questo complesso consiste eterodimero di Ikka e IKKß subunità catalitiche e una subunità normativa IKKy., L’unità IKKy chiamato anche NEMO per NF-kB modulatore essenziale. Il complesso IKK attivato, agendo prevalentemente attraverso IKKß in modo dipendente da IKKy, catalizza la fosforilazione di IkBs (in siti equivalenti a Ser32 e Ser36 di IkBa), la poliubiquitinazione (in siti equivalenti a Lys21 e Lys22 di IkBa) e la successiva degradazione da parte del proteasoma 26S. I dimeri rilasciati NF-kB (più comunemente il dimero p50-RelA), traslocano al nucleo, legano il DNA e attivano la trascrizione genica a valle.
2., Cascata di percorsi non canonici/alternativi
Un altro percorso di attivazione NF-kB chiamato percorso no-canonico o alternativo. Questo percorso è indipendente da IKKß e IKKy, ma dipende da Ikka dimmer invece. Il trasferimento di segnalazione nel citoplasma attraverso il recettore LT-β o BAFF. Fosfonati una proteina NIK, la proteina NIK quindi fosfona gli omodimmeri IKKa. L’obiettivo per gli omodimeri di IKKa in questa via è NF-kB2 / p100, che è fosforilato a due siti del C-terminale., La fosforilazione di questi siti è essenziale per il trattamento da p100 a p52, che dipende anche dalla poliubiquitinazione e dalla degradazione proteasomale. Tuttavia, invece di portare alla completa degradazione di p100, come visto con IkBs, l’ubiquitinazione dipendente dalla fosforilazione di p100 si traduce solo nella degradazione delle sue mezze parti C-terminali inibitorie. Una volta che la metà C-terminale è degradata, la porzione N-terminale di NF-kB (il polipeptide p52 che contiene il RHD) viene rilasciato., Poiché il RHD di p100 è più comunemente associato a RelB, l’attivazione di questa via “alternativa” provoca la traslocazione nucleare dei dimeri p52–RelB. Il dimero infine legarsi al DNA e attiva la trascrizione del gene down-stream.
3. Il regolamento di via
ubiquitin è una proteina dell’amminoacido 76 che altamente è conservata e ubiquitously espressa in tutti gli eucarioti dal lievito all’essere umano. L’acido carbossilico nella glicina C-terminale dell’ubiquitina può essere attaccato covalentemente all’ammina epsilon della lisina su un’altra proteina attraverso un legame isopeptidico. Questo processo è chiamato “ubiquitinazione”., Inoltre, la coda C-terminale dell’ubiquitina può essere direttamente collegata alla metionina N-terminale di un’altra ubiquitina per formare una catena di poliubiquitina lineare. L’ubiquitinazione svolge un ruolo essenziale nella regolazione dei percorsi NF-kB. Nelle cellule non stimolate, NF-kB si lega alle proteine inibitorie della famiglia kB (IkB) e viene sequestrato nel citoplasma., Su stimolazione, IkB è fosforilato dal complesso della chinasi di IkB (IKK), IKB fosforilato successivamente è ubiquitinato e degradato dal proteasoma 26S, così permettendo a NF-kB di traslocare al nucleo, in cui regola l’espressione di una pletora di geni. Come subunità regolatrice del complesso IKK, NEMO è stato proposto per essere il fattore chiave per trasdurre il segnale di ubiquitinazione all’attivazione IKK. Diversi DUBs funzionano come regolatori negativi chiave di IKK per consentire uno stretto controllo dell’attivazione di NF-kB., Uno dei DUBs meglio studiati è A20, È stato proposto che A20 sopprima l’iperattivazione di NFkB deubiquitinando la poliubiquitina legata a K63 attaccata a RIP1 attraverso il dominio OTU N-terminale, oltre a promuovere la poliubiquitinazione legata a K48 di RIP1 per la degradazione proteasomica.
4. Segnalazione a valle
NF-kB agisce come mediatore centrale delle risposte immunitarie e infiammatorie ed è coinvolto nelle risposte allo stress e nella regolazione della proliferazione cellulare e dell’apoptosi. I rispettivi geni bersaglio NF-kB consentono all’organismo di rispondere efficacemente a questi cambiamenti ambientali., La via classica di NF-kB è attivata da vari segnali infiammatori, con conseguente espressione coordinata dei geni immuni infiammatori e innati multipli. Le citochine proinfiammatorie IL-1b e TNF-a attivano NF-kB e la loro espressione è indotta in risposta all’attivazione di NF-kB, formando così un ciclo di avanzamento di amplificazione. Il percorso alternativo per NF-kB si traduce in traslocazione nucleare di dimeri p52-RelB, è strettamente dipendente dagli omodimeri IKKa e viene attivato da LTbR, BAFF e CD40L da NIK., Molti dati suggeriscono fortemente che la via alternativa svolge un ruolo centrale nell’espressione dei geni coinvolti nello sviluppo e nel mantenimento degli organi linfoidi secondari. I fattori di trascrizione della famiglia NF-kB controllano l’espressione di un gran numero di geni bersaglio in risposta ai cambiamenti nell’ambiente, contribuendo così a orchestrare le risposte infiammatorie e immunitarie.
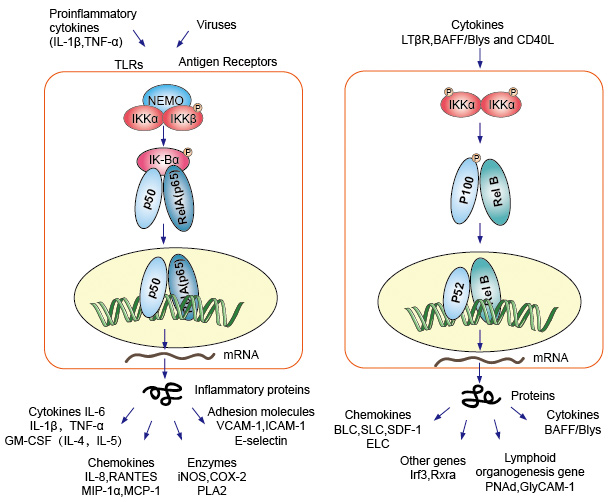
Figura 4. Down-stream di segnalazione di NF-kB percorso di segnalazione.
5. Relazione con le malattie.
- La base infiammatoria delle malattie metaboliche.,
La via di segnalazione IKK / NF-kB è la chiave per il collegamento del metabolismo, dell’infiammazione e dell’azione dell’insulina. La maggior parte dei segnali di stress metabolico con conseguente insulino-resistenza o disfunzione delle cellule β pancreatiche, sia indotta da segnali intracellulari o extracellulari, convergono sulla chinasi IKKb attivante NF-kB e altre chinasi infiammatorie principali, la chinasi proteica attivata da JNK-mitogeno (MAPK).
- NF-kB e glicolisi.
La glicolisi può generare ATP in quantità maggiori e ad un ritmo più veloce della fosforilazione ossidativa., Il glucosio è quindi un nutriente essenziale per il cancro e le normali cellule proliferanti. NF-kB coordina molti dei segnali che guidano l’attivazione e la proliferazione delle cellule durante l’immunità, l’infiammazione e l’oncogenesi.
- NF-kB e metabolismo ossidativo.
NF-kB governa l’omeostasi energetica e l’adattamento metabolico controllando l’equilibrio tra glicolisi e respirazione per la fornitura di energia. L’inibizione di NF-kB / RelA con vari mezzi ha diminuito il consumo di ossigeno e ha causato la riprogrammazione alla glicolisi aerobica