figuur 1. De canonieke en niet-canonieke NF-kB signaalweg
Wat is NF-kB?
NF-kB is een korte naam van de kernfactor kappa-light-chain-enhancer van geactiveerde B-cellen. Het is niet één enkele proteã ne, maar een kleine familie van induceerbare transcriptiefactoren die een belangrijke rol in bijna alle zoogdiercellen spelen. Het controleert de transcriptie van DNA, cytokineproductie, celoverleving en andere belangrijke celgebeurtenissen, spelen vooral een belangrijke rol in het regelen van de immune reactie op besmetting.
NF-kB moleculair zijn meestal dimeren., Een typische structuur van NF-kB is P50-P65 dimeer (NF-kB1/RelA). De dimeervorming is noodzakelijk voor de band van DNA, binden twee monomeren NF-kB aan DNA als dimeer. De n-eindgebieden van dimeer zijn de oorzaak van specifiek contact van DNA. De C-eindgebieden zijn gewoonlijk hoogst behouden, zijn zij de oorzaak van dimerisatie en het niet-specifieke fosfaatcontact van DNA. De hele NF-kB moleculaire is net als een tang bankschroef op de DNA-keten en functioneren als een transcriptiefactor (figuur 2).
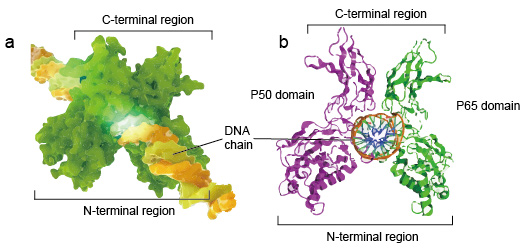
Figuur 2. De structuur van NF-kB eiwitdimer band met de ketting van DNA.,
NF-kB familie
omdat NF-kB familieleden structurele homologie delen met de retrovirale oncoproteïne v-Rel. dus noemden ze ook NF-kB/Rel-eiwitten. De familie van de NF-kB-transcriptiefactor in zoogdieren bestaat uit 5 proteã nen: p65/RelA, RelB, c-Rel, p105/p50 (NF-kB1), en p100/p52 (NF-kB2). Deze 5 proteã nen associëren met elkaar en vormen verschillende transcriptioneel actieve homo/heterodimere complexen (Figuur 3). Ze delen allemaal een gemeenschappelijk behouden rel homologie domein (RHD) van 300 aa lengte., Deze RHD domein hebben veelvoudige functies zoals dimerisatie, de band van DNA, interactie met IkBs, en nucleaire translocatie. Hoewel de leden van de NF-kB-eiwitfamilie tot 15 verschillende dimeren kunnen vormen, maar velen van hen hebben nog niet aangetoond. De meest overvloedige vorm van NF-kB dimeer is P50/P65 heterodimer die Fonds in bijna alle celtypes is geweest. Aangezien slechts P65 / Rel, RelB en c-Rel carboxy-eindtransactivation domeinen (TAD) hebben, kan de familie NF-kB van proteã nen verder in twee groepen worden verdeeld., p50 en p52 worden gegenereerd door de verwerking van de precursormoleculen p105 en p100, respectievelijk. Daarom zijn niet alle combinaties van Rel dimeren transcriptioneel actief.
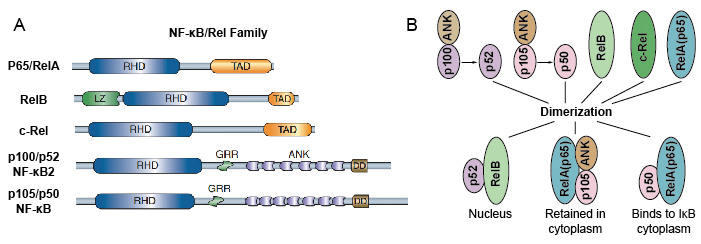
Figuur 3. De 5 proteïne en hun homo / heterodimere complexen van NF-kB familie.
NF-kB signaalweg
NF-kB eiwitdimmers als nucleaire transcriptiefactor moeten ze migreren naar de kern, gecombineerd met DNA om functie te hebben. In de meeste types van de normale cellen onder rusttoestand, was NF-KB inactief en behoudt in het cytoplasma., Zij binden aan specifieke inhibitors genoemd Ik-B proteã ne, die aan het rel homologiedomein (RHD) van NF-kB kon binden en zich in zijn nucleaire functie van de localisatieopeenvolging (NLS) mengen. Deze inhibitor proteã nen, die ikba, IkBb en IkBg omvatten, bevatten 6-7 ankyrin herhalingen die band aan RHD bemiddelen. Deze herhalingen zijn ook aanwezig in de C-eindhelften van de voorlopers NF-kB2/p100 en NF-kB1/p105, die ook als IkBs functioneren en hun partners, de rel-proteã nen, in het cytoplasma behouden., Om het moleculaire NF-kB te activeren, moeten de cellen eerst het eiwit NF-kB van hun inhibitors scheiden. Er zijn twee belangrijke signalerende wegen leiden tot de Ik-B eiwitinhibitor dissociatie van NF-kB dimmer en laat de translocatie van NF-kB dimeren van het cytoplasma in de kern.
1., Canonieke/klassieke Cascade
canonieke of klassieke cascade signalering vanaf de celoppervlak receptor van pro-inflammatoire cytokines en pathogeen-geassocieerde moleculaire patronen (PAMPs) zoals de tumor necrosefactorreceptor (TNFR), toll-like receptor (TLR) en T/B-celreceptor. Deze receptoren die met hun ligandmoleculen binden en het signaal over het celmembraan overbrengen, veroorzaken de activering van het complex van IKB-kinase (IKK). De meest voorkomende vorm van dit complex bestaat uit heterodimer van ikka en ikkß katalytische subeenheden en een ikky regulerende subeenheid., De ikky eenheid ook NEMO voor NF-kB essentiële modulator genoemd. Het geactiveerde IKK-complex, dat voornamelijk via IKKß werkt op een ikky-afhankelijke manier, katalyseert de fosforylering van IkBs (op plaatsen die gelijkwaardig zijn aan Ser32 en Ser36 van Ikba), polyubiquitinatie (op plaatsen die gelijkwaardig zijn aan Lys21 en Lys22 van IkBa) en de daaropvolgende afbraak door het 26S-proteasoom. De vrijgegeven NF-kB dimeren (meestal het P50-RelA dimeer), transloceren naar de kern, binden DNA en activeren de down-stream gen transcriptie.
2., Niet-canonieke / alternatieve pathway Cascade
een andere NF-kB activerende route genaamd no-canonieke of alternatieve route. Dit pad is onafhankelijk van IKKß en IKKy, maar afhankelijk van ikka dimmer plaats. De signalerende overdracht in het cytoplasma door de Lt-β Of Baff receptor. Fosfonaat een NIK-eiwit, NIK-eiwit dan fosfonaat de ikka-homodimers. Het doel voor ikka homodimers in deze weg is NF-kB2/p100, die op twee C-eindplaatsen gefosforyleerd is., Phosphorylation van deze plaatsen is essentieel voor P100 verwerking aan p52, die ook van polyubiquitination en proteasomal degradatie afhankelijk is. Echter, in plaats van te leiden tot volledige afbraak van p100, zoals gezien bij IkBs, resulteert de fosforyleringsafhankelijke ubiquitinatie van p100 alleen in afbraak van zijn remmende C-eindhelft. Zodra de C-terminale helft is afgebroken, wordt het n-terminale gedeelte van NF-kB (het P52-polypeptide dat de RHD bevat) vrijgegeven., Aangezien de RHD van p100 meestal geassocieerd wordt met RelB, resulteert de activering van deze ‘alternatieve’ route in nucleaire translocatie van P52–RelB dimeren. Het dimeer bindt uiteindelijk aan DNA en actief de down-stream gen transcriptie.
3. Pathway regulation
ubiquitine is een eiwit van 76 aminozuren dat in hoge mate wordt geconserveerd en alom tot expressie wordt gebracht in alle eukaryoten, van gist tot mens. Het carboxylzuur in de C-terminale glycine van ubiquitin kan covalent aan het epsilonamine van lysine op een andere proteã ne door een isopeptideband worden verbonden. Dit proces wordt “ubiquitination”genoemd., Bovendien kan de C-eindstaart van ubiquitin direct aan n-eindmethionine van een andere ubiquitin worden bevestigd om lineaire polyubiquitinketen te vormen. Ubiquitination speelt een essentiële rol in de regulering van NF-kB routes. In niet-gepimuleerde cellen, bindt NF-kB aan remmende proteã nen van kB familie (IkB) en wordt afgezonderd in het cytoplasma., Na stimulatie wordt IKB gefosforyleerd door het complexe IKB-kinase (IKK), wordt gefosforyleerd IKB vervolgens ubiquitinated en gedegradeerd door 26S proteasoom, waardoor NF-kB naar de kern kan transloceren, waar het de uitdrukking van een overvloed aan genen reguleert. Als regulerende subeenheid van het IKK-complex is NEMO voorgesteld als de belangrijkste factor voor het transduceren van het ubiquitinatiesignaal naar IKK-activering. Verschillende DUBs functioneren als belangrijke negatieve regelaars van IKK om een strakke controle van de NF-kB-activering mogelijk te maken., Een van de best bestudeerde DUBs is A20, is men voorgesteld dat A20 hyperactivation van nfkb door deubiquitinating K63-verbonden polyubiquitin in bijlage aan RIP1 door het n-eind OTU domein onderdrukt, evenals het bevorderen van K48-verbonden polyubiquitination van RIP1 voor proteasomal degradatie.
4. Downstream signalering
NF-kB werkt als een centrale mediator van immuunresponsen en ontstekingsreacties en is betrokken bij stressresponsen en regulatie van celproliferatie en apoptose. De respectievelijke NF-kB doelgenen staan het organisme toe om effectief op deze milieuveranderingen te reageren., De klassieke weg NF-kB wordt geactiveerd door een verscheidenheid van ontstekingssignalen, resulterend in coördinaatuitdrukking van veelvoudige ontstekings en ingeboren immune genen. De pro-inflammatoire cytokines IL-1b en TNF-a activeren NF-kB, en hun expressie wordt geïnduceerd in reactie op NF-kB activering, waardoor een versterkende feed forward loop wordt gevormd. De alternatieve route voor NF-kB resulteert in nucleaire translocatie van P52-RelB dimeren, is strikt afhankelijk van ikka homodimers en wordt geactiveerd door LTbR, BAFF en CD40L door NIK., Vele gegevens suggereren sterk dat de alternatieve weg een centrale rol in de uitdrukking van genen betrokken bij ontwikkeling en onderhoud van secundaire lymfoïde organen speelt. De transcriptiefactoren van de familie NF-kB controleren de expressie van een groot aantal doelgenen in reactie op veranderingen in het milieu, waardoor ontstekings-en immuunreacties worden georkestreerd.
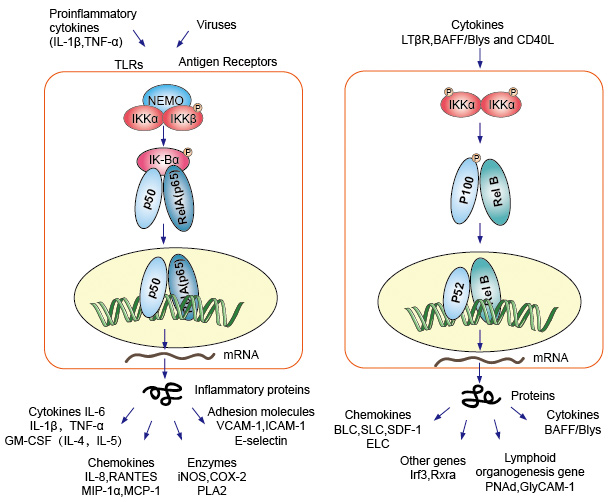
Figuur 4. Downstream signalering van NF-kB signalering pad.
5. Relatie met ziekten.
- de inflammatoire basis van metabole ziekten.,
De IKK/NF-kB signaalweg is essentieel voor het koppelen van metabolisme, ontsteking en insulinewerking. De meeste metabole spanningssignalen die resulteren in insulineresistentie of pancreatische β-celdisfunctie, hetzij geïnduceerd door intracellulaire of extracellulaire signalen, convergeren op het NF-kB-activerende kinase IKKb en andere belangrijke inflammatoire kinase, JNK-mitogen geactiveerd eiwitkinase (MAPK).
- NF-kB en glycolyse.
glycolyse kan ATP in grotere hoeveelheden en sneller genereren dan oxidatieve fosforylering., Glucose is daarom een essentiële voedingsstof voor kanker en normale prolifererende cellen. NF-kB coördineert veel signalen die celactivering en proliferatie tijdens immuniteit, ontsteking, en oncogenese drijven.
- NF-kB en oxidatief metabolisme.
NF-kB regelt de energiehomeostase en metabole aanpassing door het regelen van de balans tussen glycolyse en ademhaling voor de energievoorziening. Remming van NF-kB / RelA op verschillende manieren verminderde zuurstofverbruik en veroorzaakte herprogrammering naar aerobe glycolyse